HALOGENACIÓN DE ENOLES Y ENOLATOS
Otra consecuencia química de la enolización de aldehídos y cetonas es la reacción de halogenación en posición alfa. Puede producirse tanto a partir de la forma enólica como del ion enolato.
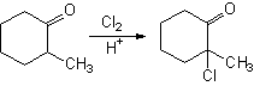
¿Cómo se halogena la 2-metilciclohexanona?
Tiene dos posiciones alfa al carbonilo, pero...
¿Por qué la reacción es regioselectiva?.
Experimentalmente se comprueba que:
1. La velocidad es de primer orden en el sustrato.
Por tanto, el halógeno no entra en absoluto en la expresión de la velocidad (es independiente de que la reacción se efectúe con Cl2, Br2 o I2).
2. La reacción muestra efecto isotópico positivo
(kH/kD > 1).
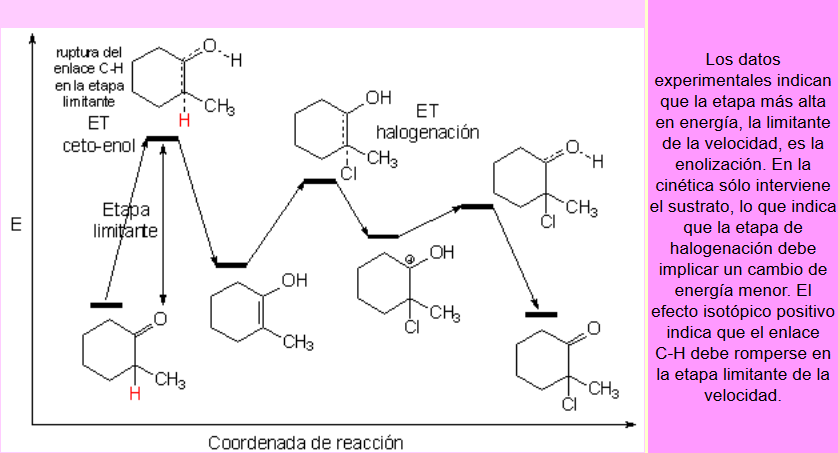
Un mecanismo compatible con estos datos experimentales debe implicar que en la etapa limitante de la velocidad sólo interviene el sustrato.
Además en esa etapa debe producirse la ruptura de enlaces C-H (efecto isotópico positivo).
La formación del enol debe ser la etapa limitante de la velocidad (ET más alto en energia): implica sólo al sustrato y en ella hay ruptura de los enlaces Calfa-H.
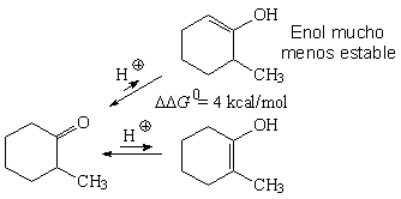
De los dos enoles posibles, el más sustituido es el más estable.
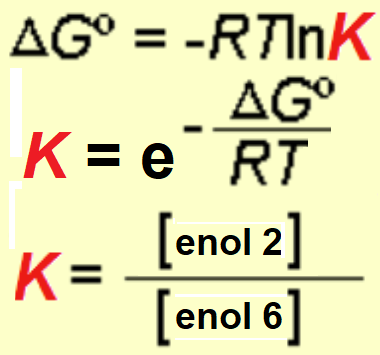
Se ha medido una diferencia de estabilidad de 4 kcal/mol entre los dos enoles lo que supone que, a temperatura ambiente, la proporción del enol-2 más estable es superior al 99.5%.
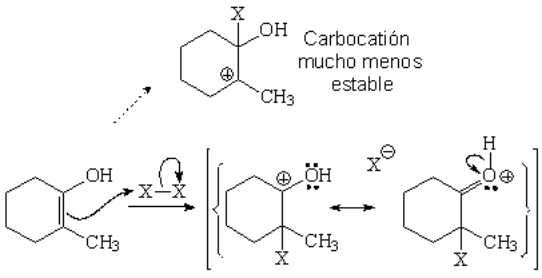 Este es otro ejemplo de cómo un átomo de oxígeno es capaz de estabilizar una carga positiva adyacente. El oxígeno de un alcohol o éter resulta dador de electrones cuando se enfrenta a un carbono sp2, como el de un carbocatión
Pincha aquí para otros ejemplos.
Este es otro ejemplo de cómo un átomo de oxígeno es capaz de estabilizar una carga positiva adyacente. El oxígeno de un alcohol o éter resulta dador de electrones cuando se enfrenta a un carbono sp2, como el de un carbocatión
Pincha aquí para otros ejemplos.
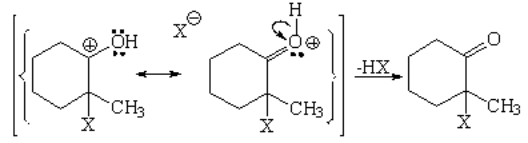
El halógeno se comporta como electrófilo. El doble enlace del enol comparte electrones con uno de los átomos de halógeno, quedandose el otro halógeno con los electrones del enlace X-X. Así ambos halógenos completan el octete. Pero el ataque al enol puede producirse de dos maneras. Se da a través del camino más fácil, es decir, a través del carbocatión menos inestable.
Por último la pérdida de un protón (que con el haluro desprendido forma el hidrácido correspondiente) da lugar a la 2-cloro- 2-metilciclohexanona.
El diagrama final de energía, siguiendo la coordenada de reacción, es cualitativamente como este:
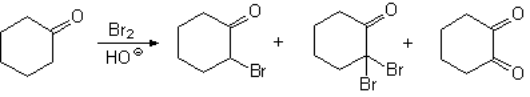
La halogenación de un aldehído o cetona en medio básico, a través del ion enolato, es más problemática porque suele dar lugar a mezclas complejas de productos.
La polihalogenación no puede evitarse.
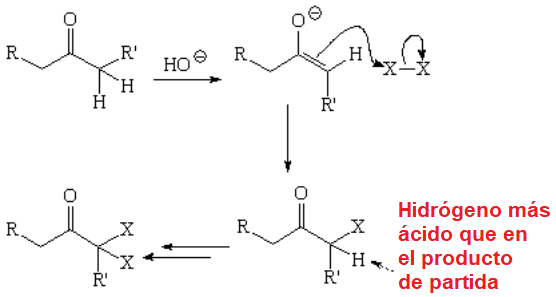
El resultado es una mezcla
Incluso, el alfa-gem-dihaloderivado formado puede evolucionar hacia una dicetona, según una reacción que ya hemos visto.
 Este es otro ejemplo de cómo un átomo de oxígeno es capaz de estabilizar una carga positiva adyacente. El oxígeno de un alcohol o éter resulta dador de electrones cuando se enfrenta a un carbono sp2, como el de un carbocatión
Pincha aquí para otros ejemplos.
Este es otro ejemplo de cómo un átomo de oxígeno es capaz de estabilizar una carga positiva adyacente. El oxígeno de un alcohol o éter resulta dador de electrones cuando se enfrenta a un carbono sp2, como el de un carbocatión
Pincha aquí para otros ejemplos.