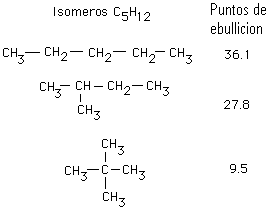
PROPIEDADES FÍSICAS DE ALCANOS
El PUNTO DE EBULLICIÓN es la temperatura a la que un líquido se convierte en gas. Las moléculas NO SE ROMPEN. Sólo dejan de atraerse unas a otras.
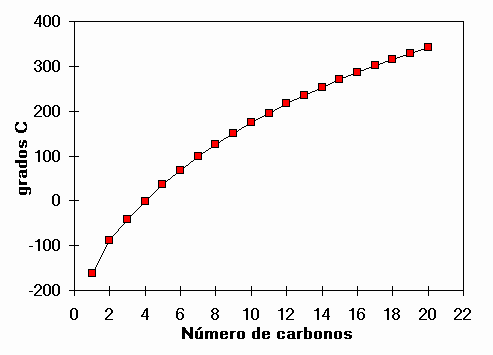 Puntos de ebullición de alcanos lineales
Puntos de ebullición de alcanos lineales
¿Cuál es el alcano que hierve a 100ºC?
El HEPTANO C7H16.
¿Cuántos átomos tiene?
VEINTITRÉS
¿Y el agua?
Sólo tres...
El PUNTO DE FUSIÓN es la temperatura a la que un sólido se funde y pasa al estado líquido. Las moléculas NO SE ROMPEN. Sólo se "desempaquetan" del estado sólido y pasan a atraerse de manera más débil en el líquido.
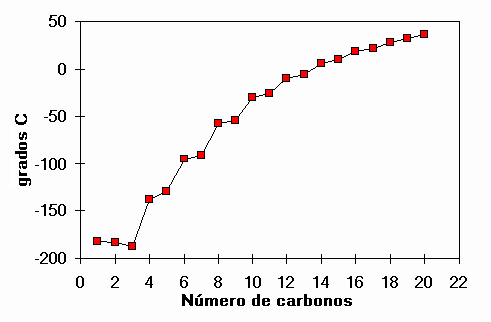 Puntos de fusión de alcanos lineales
Puntos de fusión de alcanos lineales
¿Cuál es el alcano que funde a 0ºC ?
El TRIDECANO C13H28.
¿Cuántos átomos tiene?
CUARENTA Y UNO
¿Y el agua?
Sólo tres...
La DENSIDAD nos da idea de como de compacto es un compuesto a una temperatura dada.
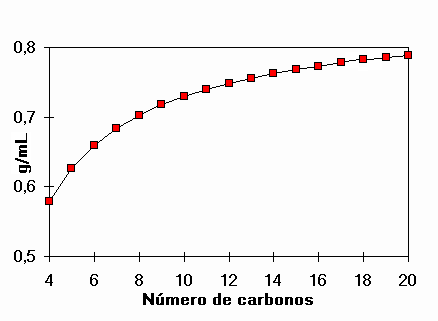 Densidad de alcanos lineales
Densidad de alcanos lineales
¿Cuál es el alcano que tiene densidad 1 g/mL ?
No se logra, ni con un número elevado de carbonos.
El agua, con sólo tres átomos logra la densidad de 1 g/mL.
Está claro que las moléculas de agua, de sólo 3 átomos, se atraen unas a otras con muchísima más fuerza que los alcanos, que necesitan 23 átomos para igualar el punto de ebullición del agua.
 Fuerzas de dispersión (London)
Fuerzas de dispersión (London)
DÉBILES
 Fuerzas dipolares
Fuerzas dipolares
FUERTES
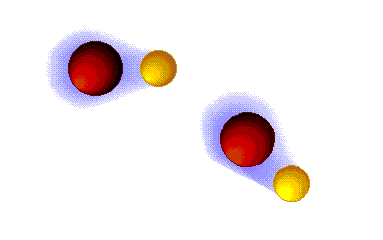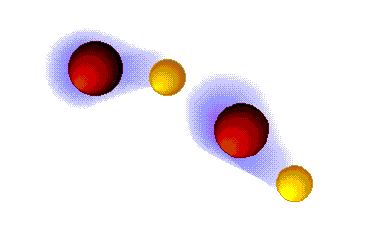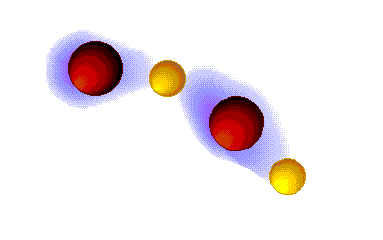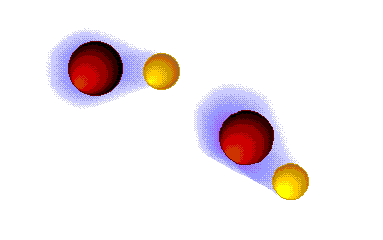 Enlace ("puente") de hidrógeno
Enlace ("puente") de hidrógeno
MUY FUERTES
La interacción entre moléculas (FUERZAS INTERMOLECULARES) es un balance entre la REPULSIÓN de los electrones externos y la ATRACCIÓN de los núcleos de una molécula sobre los electrones de las que están próximas.
 Fuerzas de dispersión (London)
Fuerzas de dispersión (London)
Son las fuerzas intermoleculares más débiles, las únicas que pueden tener lugar entre moléculas de alcanos.
Los alcanos sin átomos electronegativos tienen un "caparazón" de electrones relativamente denso y continuo. La repulsión de las nubes electrónicas es importante y por ello la atracción entre moléculas de alcano es muy débil.
La "forma" de las moléculas afecta a la superficie de contacto. ¿Qué te sugieren estos datos experimentales? Las moléculas sin ramificar, con estrutura lineal en zig-zag, se atraen de forma más efectiva.
 Puntos de ebullición de alcanos lineales
Puntos de ebullición de alcanos lineales
 Puntos de fusión de alcanos lineales
Puntos de fusión de alcanos lineales
 Densidad de alcanos lineales
Densidad de alcanos lineales
 Fuerzas de dispersión (London)
Fuerzas de dispersión (London) Fuerzas dipolares
Fuerzas dipolares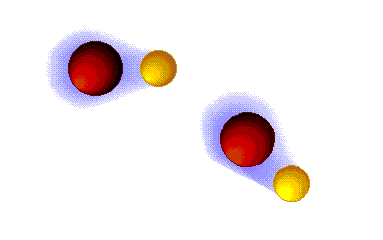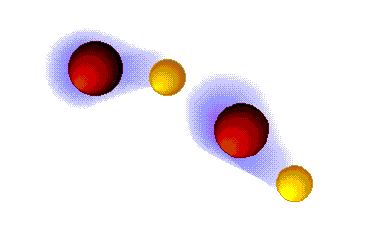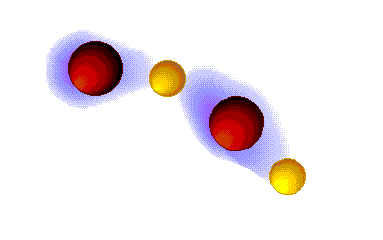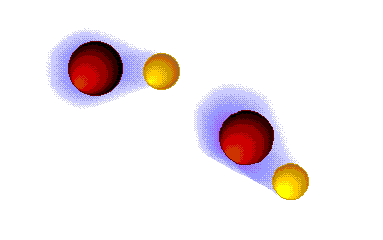 Enlace ("puente") de hidrógeno
Enlace ("puente") de hidrógeno Fuerzas de dispersión (London)
Fuerzas de dispersión (London)