PROPIEDADES ÁCIDO-BASE DE ÉSTERES
Basicidad del Grupo Carbonilo
La basicidad de un grupo carbonilo puede estudiarse a partir de la acidez de su forma protonada. Cuanto más ácida la forma protonada, menos básico será el grupo carbonilo de partida.
La forma protonada de un grupo carbonilo será más estable (menos ácida) cuanto más participe la tercera forma resonante. Por tanto, un grupo carbonilo será más básico cuanto más capacidad de dar electrones tenga el grupo L.
¿Puedes explicar los valores de pKa de los siguientes grupos carbonilo protonados, utilizando el razonamiento anterior?
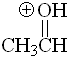 Aldehído
Aldehído
pKa = -8.0
La tercera forma resonante no es posible cuando L es un hidrógeno. La forma protonada es muy inestable. Los aldehídos son los menos básicos de esta serie.
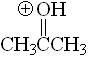 Cetona
Cetona
pKa = -7.2
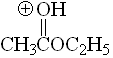 Éster
Éster
pKa = -6.5
El grupo alcoxilo puede estabilizar la carga positiva por efecto mesómero. Por ello los ésteres son más básicos que las cetonas.
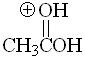 Ácido
Ácido
pKa = -6.0
La primera y tercera formas resonantes son equivalentes en un ácido protonado. Eso le da una estabilidad adicional que hace que paradójicamente un ácido sea el más básico de esta serie.
Acidez de los Hidrógenos en alfa
Al igual que en aldehídos y cetonas, los hidrógenos en alfa resultan débilmente ácidos, debido a la estabilización del anión resultante que provoca la deslocalización de la carga negativa hacia el grupo carbonilo.
¿Qué influencia tiene el grupo L?
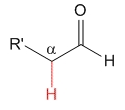 Aldehído
Aldehído
pKa = 17
El hidrógeno no ejerce ningún efecto especial y podemos tomar el valor de pKa = 17 como referencia de acidez de hidrógenos en alfa a un grupo carbonilo.
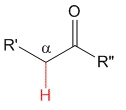 Cetona
Cetona
pKa = 20
El grupo metilo es dador de electrones por efecto inductivo y por tanto desestabiliza el anión, haciendo que los hidrógenos en alfa sean menos ácidos que en los aldehídos
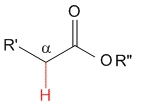 Éster
Éster
pKa = 25
Los grupos alcoxilo son fuertes dadores de electrones por efecto mesómero e inestabilizan todavía más el anión, haciendo que los hidrógenos en alfa a un éster sean los menos ácidos de esta serie.
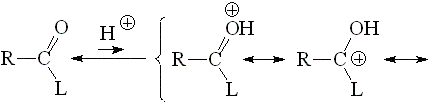
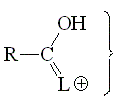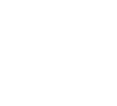
 Aldehído
Aldehído
 Cetona
Cetona
 Éster
Éster