Para transformar un ácido carboxílico en un éster deberemos convertir el grupo OH en buen saliente y tratarlo con un alcohol que es un nucleófilo débilmente básico.
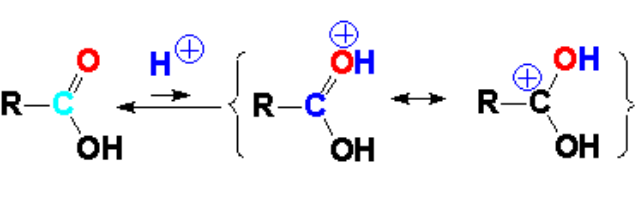
La reacción se lleva a cabo con una cantidad catalítica de un ácido mineral (clorhídrico o sulfúrico) que es capaz de protonar el grupo carbonilo, débilmente básico.
La protonación del carbonilo aumenta la electrofilia del carbono y, por tanto, su reactividad y puede ser así atacado por nucleófilos débiles, como el oxígeno de un alcohol.
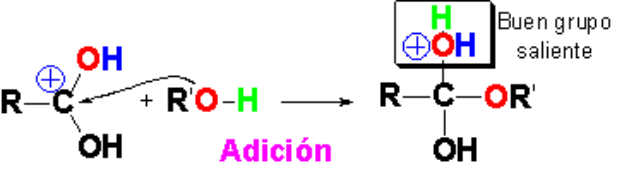
En presencia de un exceso de alcohol, que suele ser el disolvente de la reacción, se produce el ataque nucleófilo.
Los pares de electrones no compartidos del oxígeno alcohólico atacan a las moléculas de ácido carboxílico protonadas. Se forma un intermedio tetraédrico que posee una molécula de agua incipiente como buen grupo saliente.
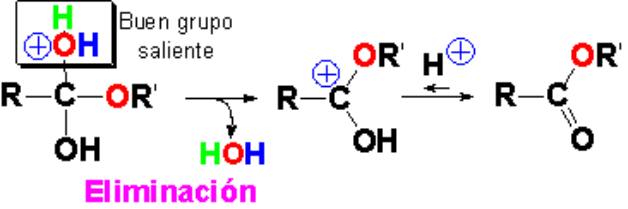
La pérdida de agua reintegra la estructura protonada del grupo carbonilo, que ya está unido al oxígeno alcohólico.
La desprotonación del intermedio trigonal conduce al éster.
La reacción de formación de un éster se produce en medio ácido, en presencia de un exceso de alcohol y en ausencia de agua.
Al contrario, un éster puede convertirse en ácido carboxílico en medio ácido, en presencia de un exceso de agua.
El mecanismo de ambas reacciones es el mismo. En el primer caso miraremos los procesos anteriores de izquierda a derecha y, en el segundo, de derecha a izquierda.